超共役とは?(共役二重結合との違い)
一般的な共役とは、二重結合と二重結合の重なり(p軌道ーp軌道)ですが、超共役は、sp3などの結合を持つ軌道との相互作用です。
軌道のエネルギーは、En=h2n2/8mL2で表されます。注目してほしいのは、L(電子の移動距離)が分母にあり、しかも2乗となってます。つまり、少しでも電子の移動領域が広がれば、化合物のEn(軌道エネルギー)が低下し、安定な分子になります。
分子軌道が共役により長くなると、軌道エネルギーが低下します。また、吸収する光のエネルギーも紫外領域から可視領域へと低下し、色を持ち始めます。
.png)
超共役は、メチル基の隣接位でみられる相互作用です。メチル基のHOMO電子(便宜上C-H HOMOで描画)が隣にある空軌動やπ結合と相互作用することで、電子供与に基づく効果が表れます。(メチル基の電子供与効果)
メチル基が電子を供与できる原理
メチル基は、特にローンペアを持っているわけでもなく電子供与となると少し疑問が生じる。しかし、メチル基の分子軌道を見てみると、ψ2とψ3が算出され、このうちψ3が電子許与能を示す可能性が示唆されている。必ずしもこの解説が正解というわけではありませんのでご注意ください。
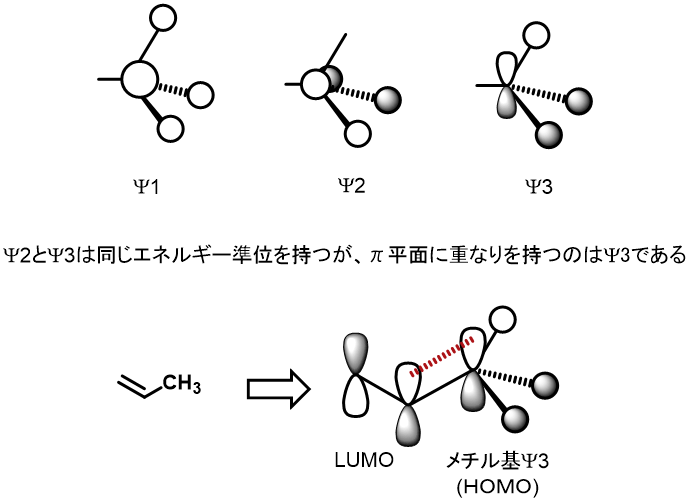
この「分子軌道」を見ると、理解に苦しむ方が多いでしょう。「Csp3–H結合×3つ」がメタンじゃないの?という考えが普通だと思います。
共有結合は、二つの軌道が重なり、一つの新しい軌道を構成することで形成されます。またその際反結合性軌道も新たに生じます。
結合が3つ(Csp3–H結合×3)あれば、その3つが1つ(分子)になったもの(分子軌道)として計算することができます。そうして導きだされたものが上の3つの軌道だと思って頂ければよいかと思います。当然この反結合性軌道も導きだされます。気を付けていただきたいのは、Csp3–H結合×3の2電子×3が、ψ1の分子軌道に2電子、ψ2の分子軌道に2電子、ψ3の分子軌道に2電子が収まっているということです。
