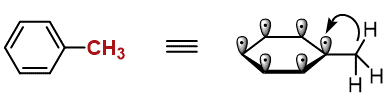薬学部に入って有機化学を学び始めると登場する、最初の壁だと思います。
電子求引基と電子供与基
の簡単な理解方法を解説します。
[電気陰性度が高い置換基が、電子を引っ張る]ということは、多くの人が理解できている
のですが、
芳香族化合物に置換した場合、必ずしも
高い電気陰性度=電子求引基
ではありません。
もう一度言っておきます、
「芳香族に置換した場合」です!
芳香族に置換している置換基が、芳香環上の電子を引く度合いは、
電気陰性度とは関係ありません!
芳香族に置換した場合、電気陰性度による誘起効果(σ結合の電子求引)よりも、共鳴効果が優先的に影響します。
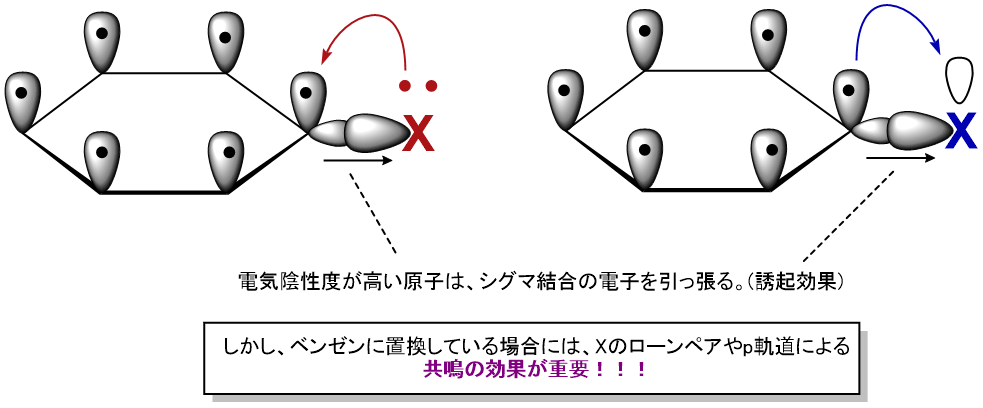
この特徴を理解するためには、一度頭をリセットし、電気陰性度を無視します。
そして、ベンゼン環に直接置換している原子に着目しましょう。
ポイントは…置換基が持っている軌道です!
芳香環に直接置換している原子が、
空のp軌道を持っている場合、電子求引基
ローンペアを持っている場合、電子供与基
として働きます!
では、芳香族化合物に置換した場合の電子求引基、電子供与基のふるまいの変化を解説します。
※本記事では「簡便な理解」を優先するため、反応の主要な矢印以外を省略しています。
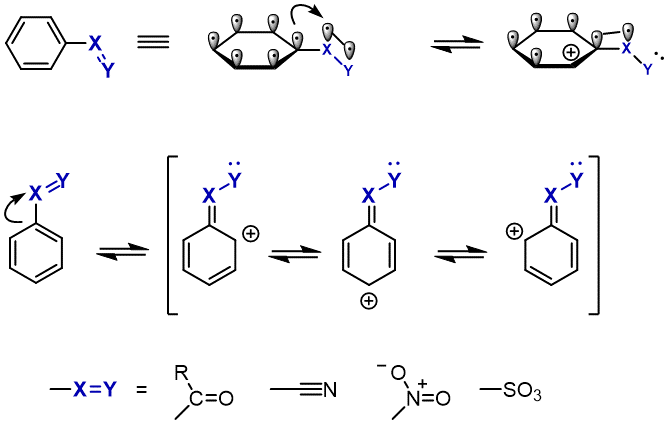
電子求引基と電子供与基の構造的特徴
電子求引基は、ベンゼン環に置換している原子が
空軌道もしくは電子欠損なp軌道を持っています。

電子求引基とは、その名の通りベンゼン環から電子を奪う置換基です。
ベンゼン環から電子を奪うためには、電子を受け取る軌道が必要です。
電子を受け入れることができるのが、P軌道です。
特に、カルボニル基(C=O)やニトロ基(NO2)は、ベンゼン環と直接結合している炭素や窒素のp軌道が、
二重結合を形成している酸素に引っ張られているため、強力な電子求引基として働きます。
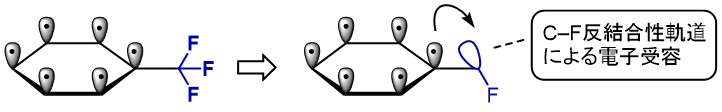
トリフルオロメチル基は、CーF反結合性軌道があるために、電子求引基として働きます。
電子供与基は、ベンゼン環に置換している原子がローンペア(非共有電子対)を持っています。このローンペアを使って電子を供与します!
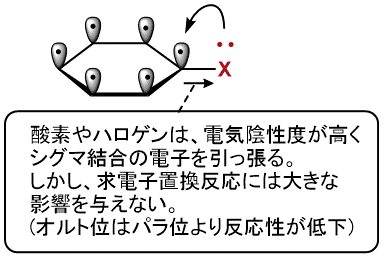
非共有電子対を持つ置換基には、酸素やハロゲンなどの電気陰性度の高いものが多いです。
電気陰性度の影響により、Xが直接接している炭素のσ結合、次いでオルト位の炭素の電子密度を下げてしまいます。
で・す・が!
芳香環上のπ電子系に対する、影響のほうがはるかに大きいです!
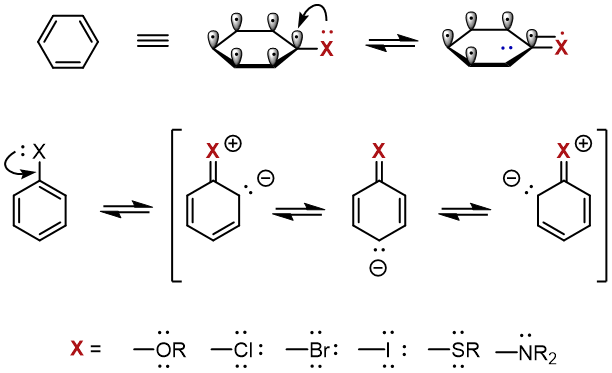
このように、電子供与基の特徴は、ローンペアを持っていることです。
代表的な置換基の例としては、O、N、S、ハロゲンが挙げられます。
「ローンペアがあるかないか」に着目すればいいので、理解はしやすいですね。
ちなみに、この効果はベンゼン環に結合している原子とベンゼン環の距離が大切で
C-O結合とCーS結合を比較した場合、C-Oの方が結合が短いために電子供与効果が
強くなります。
芳香環上で進行する反応に対する置換基の効果(活性化基・不活性化基)
芳香族の置換基のことを、活性化基や不活性化基と表現することがありますよね?
これは、求電子反応に対して、活性か否かということを意味しています。
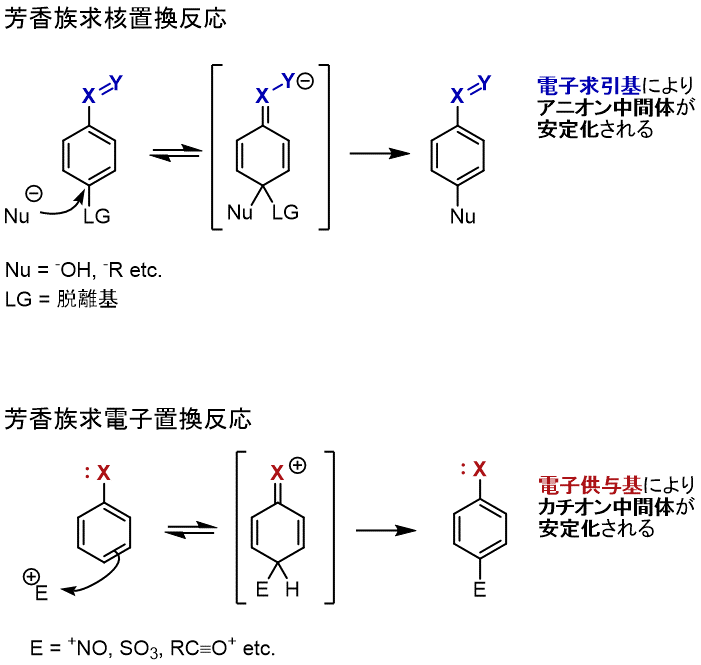
ベンゼン環の様な、芳香族化合物上で置換反応が進行する際、2つの反応機構が想定できます。
求核的な置換と求電子的な置換です。
求核置換反応では、何らかの脱離基(LG: Leaving group)が求核種(Nu)と入れ替わります。
この時アニオン中間体が生じるので、電子求引基が置換していれば反応は加速されます。
求電子置換反応では、求電子種がベンゼン環の電子を奪う機構で進行します。
この反応は、カチオン中間体が生じるので、電子供与基が置換して入れば反応は加速されます。
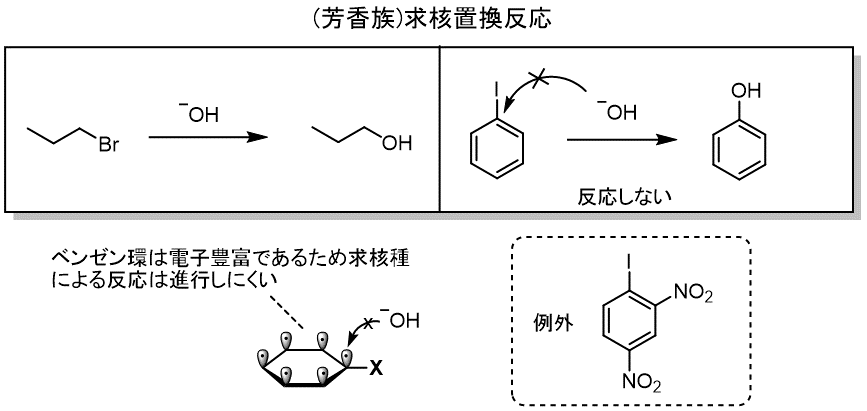
ベンゼン環では、求核反応はほとんど起きません。
どんなに強力な脱離基が置換していても、ベンゼン環が電子豊富であるため、
反応が進行しにくい状態にあります。
ここではあまり触れませんが、例外でニトロのような強い電子求引基を複数有している場合には、
マイゼンハイマー錯体を経由して置換反応が進行します。
なので、ベンゼン環上での反応は、求電子的な反応(芳香族求電子置換反応)が一般的になります。
ベンゼン環に関する求核的な方法は用いることができないので、
ベンゼンを変換する反応の多くが、必然的に求電子的な変換となります。
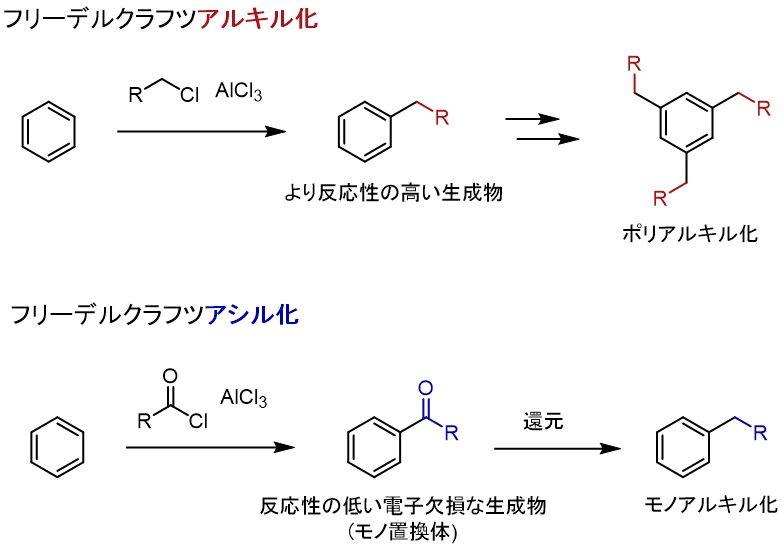
試験によく出るフリーデルクラフツアルキル化/アシル化反応に触れておきます。
フリーデルクラフツアルキル化では、アルキルハライドとAlCl3のようなルイス酸を用いることでアルキル化が進行します。
しかし、得られる生成物は電子供与気であるアルキル基を有することから、原料のベンゼンよりも電子豊富で反応性が高くなります。そのため、ポリアルキル化合物が生成します。
これではモノアルキル生成物を合成することはできません。その代わりに、酸ハロゲン化物とルイス酸を用いる、フリーデルクラフツアシル化反応が登場します。
この方法では、アシル化を行い、還元することでモノアルキル置換体を得ます。
アシル化では、生成物が電子欠損で反応性が低いことから、置換反応回数の制御が可能です。
オルト/パラ、メタ配向性(ここ重要!!)
電子求引基がメタ配向性、電子供与基がオルト/パラ配向性といいますが
それは、あくまでも
「求電子置換反応において」という前提
があることを忘れないでください。
電子求引基はオルト/パラ位の電子密度を低下させることで、
求電子反応がメタ位でしか進行しないようにしています。
電子供与基はオルト/パラ位の電子密度を上昇させることで
求電子反応がオルト/パラ位で進行しやすくさせています。
電子求引基・電子供与基の強さの決められ方(Hammet値)
電子供与や電子求引の程度は、Hammet値によって決定されています。
Hammet値を見れば細かい強弱は理解することができます。
ケムステにいい記事があるので参照ください。
σ = log(KR/KH)
で評価されますが、置換基Rが芳香族上での求電子置換反応を、無置換体Hと比べて促進していれば、マイナスの値をとります。
つまり、小さい方が活性化基となりますね。
ざっくりとまとめましたが、少しでも読者の理解に役立てば幸いです!
最後まで読んでいただきありがとうございました!